J’ai adoré échanger avec le professeur Harry Sokol, gastro-entérologue au CHU Saint-Antoine à Paris, un homme passionné par son métier et passionnant.
Je lui ai proposé d’intervenir sur cette thématique du microbiote intestinal, ses déséquilibres et nos maladies digestives, dont il est un expert reconnu mondialement. Et d’aborder les solutions disponibles aujourd’hui et celles de demain. Dirigeant plusieurs équipes de recherche (AP-HP, INSERM, INRAe), il est un acteur de premier plan de la médecine de demain mais il est aussi un excellent vulgarisateur.
Cela donne une mini-conférence de 35 minutes suivie de 15 minutes de questions-réponses, où j’ai pu lui poser les questions que vous m’aviez soumises. La conférence est destinée au grand public, tout en restant pointue.
J’espère que cela vous plaira !
Je ne peux que vous recommander la BD du Pr Sokol, un fantastique ouvrage de vulgarisation sur ces mêmes thèmes, Les extraordinaires pouvoirs du ventre, j’en parle dans cet article.
Plusieurs formats disponibles
Selon votre préférence, vous pouvez :
- Consulter la vidéo ci-dessus : le format le plus complet, car vous avez le support des diapositives qui illustrent les propos tenus.
- Les sous-titres sont générés automatiquement (et peuvent donc avoir quelques erreurs)
- Au format podcast si vous préférez l’audio :
- Dans n’importe quel navigateur web ici.
- Flux RSS pour l’ajouter à une autre application de podcast
- Au format texte, grâce à la retranscription ci-dessous :
Qu’est-ce que le microbiote intestinal ?
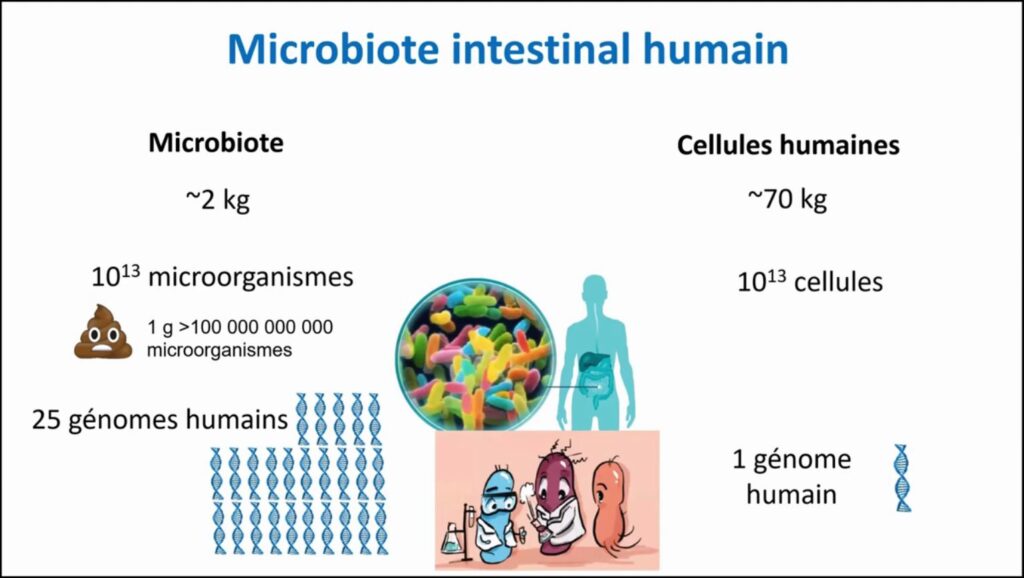
Le microbiote intestinal est l’ensemble des microorganismes qui sont dans notre intestin. On estime que pour un adulte qui fait à peu près 70 kilos, on a deux kilos de contenu intestinal. Il ne s’agit pas que de microorganismes. Il y a aussi beaucoup d’autres choses, de l’eau notamment.
On estime aujourd’hui que l’on a autant de bactéries dans l’intestin que de cellules dans notre corps, c’est-à-dire 10 13 microorganismes. Pour vous donner un exemple, dans un gramme de matières fécales, vous avez plus de 100 milliards de microorganismes. Dans nos cellules humaines, on a bien sûr le génome humain, comme vous le savez.
Si l’on met bout à bout les gènes des microorganismes qui sont présents dans un intestin humain, cela représente 25 fois la taille du génome humain. Ce qui vous donne une idée de la quantité d’informations présente, mais également cela vous indique une activité métabolique extrêmement riche. On considère que chacune de ces bactéries est responsable d’une activité métabolique, qui peut produire des molécules et l’on va en reparler après.
Types du microbiote intestinal
Dans l’intestin on a des bactéries, c’est ce que l’on connaît le mieux en tout cas. Dans le côlon, elles appartiennent à ces deux grands groupes, ici en rouge et en jaune, avec des noms barbares : bacteroidetes et firmicutes. Ce qui est important, c’est de savoir que dans le côlon, c’est des bactéries anaérobies, c’est-à-dire qu’elles poussent en l’absence d’oxygène puisqu’il n’y a pas d’oxygène dans notre côlon. D’autre part, ces bactéries sont extrêmement difficiles à faire pousser avec des méthodes de bactériologie classique.
On sait aujourd’hui que dans l’intestin, on a d’autres types de microorganismes : des champignons, des levures, des virus, notamment ce que l’on appelle des phages. Les phages sont des virus qui ne vont pas infecter nos cellules humaines comme par exemple le virus du Covid qui infecte nos cellules.
Ces virus vont affecter les bactéries, et de ce fait moduler potentiellement les populations de bactéries dans l’intestin. Il y a encore d’autres types de microorganismes, ce que l’on appelle des Archaea et les protistes. Il y a un grand nombre de microorganismes différents qui sont au même endroit et forment un véritable écosystème, avec des interactions un peu comme un réseau social présent dans notre intestin.
Caractéristiques du microbiote intestinal
Ce microbiote a plusieurs caractéristiques avec une très grande diversité de microorganismes différents.
La deuxième grande caractéristique : ces microorganismes ont une très grande capacité d’adaptation aux changements de l’environnement. C’est d’ailleurs pour ça qu’à la surface de la terre, on va retrouver des bactéries partout, même dans les conditions les plus extrêmes.
Variation du microbiote le long du tube digestif
Comme ces microorganismes s’adaptent à l’environnement et que l’environnement intestinal n’est pas du tout le même en haut de l’intestin grêle et à la fin du côlon, de manière assez logique, on ne va pas retrouver les mêmes types de microorganismes dans toutes les zones de l’intestin.
La concentration en bactéries va progressivement augmenter le long de l’intestin grêle et du côlon. Plus on descend, plus la densité et la concentration de microorganismes est importante et moins il y a d’oxygène. On va avoir donc un changement du type de bactéries. Dans le côlon (le gros intestin), on va avoir essentiellement des bactéries anaérobies qui poussent sans oxygène, alors que dans la partie plus haut de l’intestin grêle, on va avoir aussi des bactéries aérobies qui poussent en présence d’oxygène.
Différences et points communs du microbiote chez les humains
Un élément particulièrement intéressant, c’est qu’on a chacun un microbiote qui nous est propre. Ici, c’est une image qui est issue d’un article qui a presque 20 ans maintenant, qui utilise une méthode qu’on utilise d’ailleurs plus aujourd’hui, mais ce que l’on représente, c’est assez visuel. On a pour chaque individu un code barre qui représente un petit peu le microbiote de la personne. Ici, vous avez quatorze individus sains et ce que l’on voit de manière assez simple, c’est que ces codes-barres sont tous différents.
Ce qui veut dire que l’on a chacun un microbiote qui nous est propre. Néanmoins, il y a quand même des points communs. Ici c’est un travail qui a une dizaine d’années, mais qui est toujours d’actualité. Si on analyse le microbiote comme ça de plusieurs centaines de personnes, on va retrouver certaines espèces bactériennes présente seulement chez une personne sur deux à peu près.
On va retrouver aussi certaines espèces qui vont être présents chez 90 % des sujets. Ce sont déjà des bactéries qui sont beaucoup plus fréquentes et puis on a certaines espèces bactériennes qu’on va retrouver chez tout le monde. Dans cette étude, il y avait 18 espèces de ce type, ce qui fait qu’on peut considérer que ces espèces bactériennes qu’on retrouve chez tout le monde sont un peu des piliers du microbiote intestinal.
C’est comme si on prenait des êtres humains : on peut dire que tous les êtres humains sont différents, mais en même temps, ils ont tous une tête, deux bras, deux jambes. Ils ont quand même des points communs, des caractéristiques communes. C’est un peu pareil avec les microbiotes.
Facteurs influençant le microbiote
Ce qui est important, c’est que tout ça n’est pas figé. Le microbiote n’est pas complètement figé dans le temps et il y a beaucoup de facteurs qui vont influencer ce microbiote. Certains facteurs viennent de nous. Notre génétique, nos cellules immunitaires notamment, et puis des facteurs qui viennent de notre environnement au sens large.
Période néonatale
Quand on parle d’environnement et de microbiote, il y a deux grandes périodes dans la vie.
D’abord, il va y avoir tout ce qui se passe en période néonatale puisque je vous rappelle que dans l’utérus maternel, aucune bactérie n’existe. On est stérile entre guillemets dans l’utérus maternel, et on va rencontrer les premiers microorganismes à partir de la naissance.
Mode de naissance et d’alimentation
Ce n’est évidemment pas du tout pareil d’un point de vue microbiologique d’avoir une naissance par voie basse, par voie vaginale, au cours de laquelle on va rencontrer des bactéries du vagin maternel, mais aussi des bactéries fécales. C’est complètement différent si on a une naissance par césarienne ou là, on va rencontrer des bactéries de la peau et puis de la salle d’opération finalement.
Il y a plein d’autres facteurs qui vont jouer un rôle dans ses premières interactions avec le monde microbien et également, la constitution du microbiote, le mode d’alimentation. Le lait maternel contient des bactéries du microbiote intestinal et des molécules issues du microbiote.
Même si les industriels essayent de produire des laits artificiels qui se rapprochent du lait maternel, on est encore très loin de pouvoir le mimer. Bien sûr, l’exposition à des antibiotiques tôt dans la vie, peut avoir un effet et puis tout simplement l’endroit où l’on vit. Ce n’est pas du tout pareil d’un point de vue microbiologique de vivre en pleine ville où d’habiter dans une ferme à la campagne.
Ce qui est particulièrement intéressant, c’est que ces premières interactions avec le monde microbien vont laisser une forme d’empreintes sur notre système immunitaire est d’ailleurs plus globalement sur notre physiologie, c’est-à-dire sur la manière dont notre corps fonctionne.
On pense aujourd’hui que si ses premières interactions avec le monde microbien sont altérées, s’il y a des choses qui viennent interagir d’une mauvaise manière, ça va induire une forme de mauvaise éducation de notre système immunitaire, avec potentiellement des conséquences sur la survenue de maladies beaucoup plus tard dans la vie, y compris à l’âge adulte.
Période de constitution de microbiote après la naissance
Sur le mode d’accouchement, la constitution du microbiote intestinal au cours du temps après la naissance va de 0 jusqu’à 36 mois, c’est-à-dire trois ans. On voit les grands groupes du microbiote qui vont s’installer les uns après les autres. C’est le cas d’enfants nés par voie vaginale. On a d’abord des bactéries jaunes qui sont présentes avec ces bactéries bleues et puis progressivement, on voit l’apparition de ces bactéries violettes jusqu’à atteindre une forme d’équilibre.
On voit chez les enfants qui sont nés par césarienne qu’au cours des douze premiers mois, Il y a une très grande différence avec les enfants qui sont nés par voie vaginale.
Vous voyez notamment que le groupe bleu manque quasiment complètement et qu’au contraire, on a ce groupe de bactéries violettes et des bactéries vertes qui sont dominantes chez les enfants nés par césarienne. Néanmoins, vous voyez qu’après l’âge d’un an, on ne voit plus vraiment de différence entre les deux groupes. On n’est plus capable de distinguer les enfants qui sont nés par voie vaginale ou par césarienne à partir de l’âge de douze mois. Néanmoins, ses premières différences tôt dans la vie pourraient avoir des effets à long terme.
Sur le graphe ci-dessus figure les résultats d’une étude faite au Danemark sur près de 600 000 enfants. Dans cette étude, les auteurs ont observé que, plus les enfants étaient exposés à des antibiotiques, plus ils avaient un risque de développer une maladie inflammatoire chronique de l’intestin, comme la maladie de Crohn.
Liens d’antibiotique et du tabac sur microbiote
Alors c’est une corrélation, ça ne veut pas dire que c’est à cause des antibiotiques, forcément que la maladie se développe, mais c’est intrigant de se dire qu’il y a eu cette association entre des perturbations tôt dans la vie avec des antibiotiques, des perturbations du microbiote et puis la survenue de ces maladies inflammatoires.
On a des données qui sont assez similaires avec d’autres types de perturbations du microbiote auprès des facteurs qui vont influencer le microbiote tel que la césarienne et le mode d’allaitement.
Chez l’homme, on n’a pas la possibilité (et heureusement) de faire des expériences et d’exposer des enfants à des antibiotiques ou pas, pour voir ce qui se passe. On ne fait pas ce genre de choses, mais on peut le faire chez la souris.
Sur la même image d’au-dessus, vous avez le résultat d’un travail fait par des collègues de l’Institut Pasteur à Paris, dans lequel ils ont perturbé le microbiote des souris au moment du sevrage avec des antibiotiques et ils ont regardé à l’âge adulte ce qui se passait.
Ils ont observé qu’à l’âge adulte, les souris qui avaient reçu des antibiotiques au moment du sevrage avaient un système immunitaire qui était mal éduqué et que ce système immunitaire induisait une inflammation intestinale plus forte que chez les souris qui n’avaient pas reçu d’antibiotiques à ce moment-là, donc il semble que ce concept soit vrai.
La vie adulte
Tout ne se joue pas dans la période néonatale. On peut faire beaucoup de choses plus tard dans la vie. La vie adulte pour le microbiote commence vers l’âge de trois, quatre, cinq ans. Vous voyez que ça commence quand même assez tôt.
Il y a encore beaucoup d’autres paramètres qui vont pouvoir avoir un effet sur notre microbiote. L’alimentation est un des facteurs absolument majeurs qui affectent notre microbiote. La richesse en fibres. On sait aujourd’hui que les additifs alimentaires présents dans l’alimentation transformée, surtout ultra-transformés sont délétères pour notre microbiote ainsi que tous ses émulsifiants, les colorants, les conservateurs etc.
Bien sûr, une exposition aux antibiotiques va avoir des effets. Le tabac a lui aussi un effet et puis on s’aperçoit que d’autres médicaments qui ne sont pas des antibiotiques ont également des effets sur notre microbiote. Si nous perturbons notre microbiote y compris à l’âge adulte, cela peut avoir des conséquences sur le fonctionnement de notre organisme.
Effet des antibiotiques sur le microbiote
Résultat d’une expérience faite sur des sujets sains qui ont reçu cinq jours d’antibiotiques.
La courbe bleu clair représente la diversité du microbiote. On voit que cette diversité est aux alentours de 400, 500 avant les antibiotiques et après les cinq jours d’antibiotiques, on voit que la diversité va chuter de manière absolument majeure. Les antibiotiques, c’est un peu comme la bombe atomique dans l’intestin. Après la fin de l’antibiothérapie, la diversité va se renormaliser et on revient à un état très proche de l’état initial. Néanmoins, si on reproduit une perturbation identique avec à nouveau des antibiotiques la diversité diminue.
Mais là sur cette image, on ne revient pas exactement à l’état initial chez cette personne et ça veut dire qu’il y a une récupération incomplète après des perturbations répétées. Pour cela, malheureusement, on n’est pas tous égaux. Il y a certaines personnes qui vont avoir une capacité de résilience. C’est comme cela qu’on appelle ce phénomène, la résilience du microbiote. La capacité à revenir à l’état initial après une perturbation qui va être excellente, et donc même s’ils prennent une fois, deux fois, trois fois, dix fois des antibiotiques finalement leur microbiote est suffisamment solide pour se récupérer.
Il y a d’autres personnes, après une, deux, trois prises d’antibiotiques leur microbiote va complètement se modifier de manière définitive avec potentiellement des effets sur la santé notamment, on parle de syndrome de l’intestin irritable post infectieux. Ce sont des personnes qui vont avoir soit une infection, soit recevoir des antibiotiques. Finalement, leur ressenti, ce qui va se passer dans l’intestin va changer de manière brutale et prolongée après ces perturbations.
Effets de l’alimentation sur le microbiote (occidentale)
Expérience sur la souris
Deuxième exemple de perturbations, l’alimentation, notamment l’alimentation occidentale. Ici, c’est une expérience qui a été fait chez la souris. La souris un végétarien, ça ne mange que des végétaux normalement. Vous avez ici une image du microbiote avec l’alimentation normale de la souris. Si on change l’alimentation de la souris, qu’on lui donne une alimentation qui est riche en protéines animales et en graisse animale, on voit que le microbiote va se modifier de manière très brutale. En quelques jours, le microbiote se modifie. Si on revient après quelques jours de perturbations à l’alimentation normale, le microbiote va revenir à son état initial.
Comparaison de microbiote des enfants africains vivant au Burkina à celui des Européens vivant en Italie
Chez l’homme, on a aussi beaucoup de données. Ici, c’est une étude ancienne, mais qui est assez parlante. Dans cette étude, les auteurs ont comparé le microbiote d’enfants vivant au Burkina Faso en zone rurale et des enfants européens, vivant en Italie. Vous avez la composition du microbiote avec les grandes familles de bactéries.
Vous voyez, il n’y a pas besoin de faire des statistiques. On voit bien que la composition est extrêmement différente entre les enfants du Burkina Faso et les enfants italiens. On voit qu’il y a un groupe des bactéries vertes beaucoup plus abondant chez les enfants africains comparées aux enfants européens.
Ces bactéries vertes représentées par le groupe vert clair sont capables de digérer des fibres végétales extrêmement résistantes présentes dans le millet et le sorgho, qui est une des bases de l’alimentation de ces enfants au Burkina Faso en zone rurale.
Inversement, en Italie et dans les pays occidentaux, on a une alimentation qui est pauvre en fibres végétales. Les bactéries qui d’habitude mangent, utilisent ces végétaux vont diminuer de manière pratique. Ce qui est embêtant parce qu’en utilisant ces fibres végétales, ces bactéries de l’intestin vont produire tout un tas de molécules qui sont très importantes pour le maintien en bonne santé de notre organisme.
Si on diminue les fibres, ces bactéries qui produisent ces bonnes molécules diminuent, donc on a moins ces bonnes molécules, avec potentiellement des effets sur la santé.
Impacts de la génétique sur le microbiote et quels effets transgénérationnels ?
Pour compliquer un tout petit peu plus les choses. Tout cela est modulé par notre génétique. La manière dont nos cellules fonctionnent et puis un autre élément intéressant peut être une vraie motivation pour changer notre mode de vie. C’est qu’il y a des effets possibles d’une génération sur l’autre.
On sait que le microbiote parental et notamment maternel, s’il est altéré, il va y avoir une transmission de ces altérations à la génération suivante.
Pendant la grossesse, les molécules issues du microbiote maternel vont passer dans le sang, le placenta et se retrouver chez le fœtus, l’embryon. Au cours de la naissance, il va y avoir une partie de la transmission des microorganismes. Au cours de l’allaitement et aussi lors des contacts rapprochés, il va y avoir aussi une forme de transmission du microbiote des parents aux enfants. Si on a un microbiote qui est altéré, on va transmettre un microbiote qui est altéré. Cette transmission, s’aggrave de génération en génération. Notre mode de vie occidental a plus de 50 ans et il y a plusieurs générations qui ont subi ces altérations. Il y a des effets comme ça, transgénérationnels et c’est ce qui explique très probablement l’augmentation de certaines maladies qui sont liées à l’environnement, mais qu’on voit apparaître dès l’âge de l’enfance parce qu’effectivement, le microbiote est altéré.
Fonctions du microbiote et le rôle qu’il peut jouer sur des maladies
Le microbiote sert à beaucoup de choses. Il a de multiples fonctions pour notre physiologie et notre métabolisme. Il va fabriquer des vitamines, détruire des toxiques que l’on ingère involontairement ainsi que les produits cancérigènes que les bactéries vont détruire pour nous. Le microbiote va aussi transformer des molécules étrangères que l’on ingère volontairement, c’est le cas des médicaments. Par conséquent, il y a tout un champ de la recherche maintenant qui émerge sur le rôle du microbiote dans l’efficacité ou la toxicité des médicaments.
Le microbiot va jouer un rôle dans ce qu’on appelle la fonction barrière. Notre intestin absorbe des calories, mais ça ne doit pas être une passoire qui est ouverte à tous les vents et n’importe quelle molécule ou agresseur. Cette fonction barrière est renforcée et stimulée par le microbiote pour produire de peptides antimicrobiens, c’est-à-dire des sortes d’antibiotiques naturels qui jouent un rôle dans la défense contre les infections.
Le microbiote va aussi stimuler la production d’anticorps dans la lumière intestinale pour la protection contre les pathogènes et rendre notre intestin le plus étanche possible.
Le microbiote va jouer un rôle majeur dans les fonctions immunitaires. Il va maturer, stimuler notre immunité dans l’intestin, mais aussi globalement dans l’ensemble de notre corps. Il va nous protéger contre les infections, notamment les infections intestinales en entrant en compétition avec les bactéries pathogènes. Si vous avez un intestin avec tout votre microbiote qui est présent, une bactérie pathogène ne va pas trouver de quoi manger ou s’installer, et donc va avoir beaucoup plus de mal à provoquer une infection.
Inversement, si vous avez un microbiote qui est altéré, qui a plein d’espace libre, plein de nutriments disponibles, même quelques bactéries pathogènes vont trouver de quoi s’accrocher, manger, proliférer et provoquer une infection.
Le lien cerveau/microbiote (ou l’axe intestin/cerveau) fonctionne dans les deux sens
Aussi bizarre que cela puisse paraître, le microbiote a des effets à distance, y compris jusqu’au niveau du cerveau. Il est évidemment logique de se dire que s’il est altéré, il va pouvoir jouer un rôle dans différentes maladies. Aujourd’hui, il y a beaucoup de maladies, que ça soit intestinales ou hors de l’intestin, pour lesquels on pense que le microbiote joue un rôle.
Pour revenir une minute sur le cerveau parce que c’est vrai qu’on se demande, comment le microbiote va agir aussi loin ? Il y a des connexions nerveuses entre l’intestin et le cerveau. Vous avez probablement tous fait l’expérience de symptômes digestifs quand on est soumis à du stress avant un examen ou un entretien d’embauche ou autre. On va avoir mal au ventre, parfois même la diarrhée. Ça, c’est le signe de ces connexions qui vont du cerveau jusqu’à l’intestin.
Ces connexions vont dans les deux sens. Le microbiote va moduler les terminaisons nerveuses au niveau de l’intestin et va pouvoir par ce biais-là avoir un effet sur la manière dont notre cerveau fonctionne.
Les bactéries de l’intestin ce sont un peu toutes de petites usines qui produisent tout un tas de molécules. Ces molécules sont produites dans un organe dont la fonction principale est d’absorber et beaucoup de ces molécules vont être absorbés. Elles vont passer d’abord par le foie parce que c’est le chemin habituel pour tout ce qui vient de l’intestin.
Au niveau du foie, certaines molécules vont être détruites, d’autres vont être transformées. D’autres vont passer à travers le foie sans être modifié et atteindre la circulation générale jusqu’au cerveau, et donc avoir des effets sur le cerveau. Ce n’est pas du tout magique, ni farfelu, il y a une base biologique et scientifique derrière ces effets.
Exemple de maladies (MICI)
Un exemple de maladie dans lequel le microbiote est impliqué, sur lequel on a quand même beaucoup d’informations et puis accessoirement, c’est mon domaine d’expertise. Ce sont les maladies inflammatoires chroniques de l’intestin que l’on appelle MICI.
Il y a deux types de MICI. La rectocolite hémorragique et la maladie de Crohn. Ce sont des maladies qui vont entraîner une diarrhée, des douleurs abdominales, parfois une fièvre. Ce sont des maladies qui touchent des sujets jeunes et vont altérer leur qualité de vie. Elles sont chroniques avec des phases de poussée inflammatoire et puis des phases de rémission ou ça va finalement mieux.
Malheureusement, on n’a pas de traitement curatif, c’est-à-dire qu’on n’a pas de médicaments pour guérir ses patients. On a des médicaments seulement pour calmer l’inflammation. Il peut y avoir différents types de complications, des poussées sévères qui mènent à l’hospitalisation. Dans certains cas, des infections et certains cancers qui peuvent être liées à l’inflammation elle-même ou favorisée par certains des médicaments qu’on est amené à donner à ces patients.
Ces maladies, on commence à peine à comprendre comment elles marchent. On dit aujourd’hui qu’elles sont liées à une activation de notre système immunitaire dans l’intestin vis-à-vis du microbiote chez des sujets qui ont une susceptibilité génétique, et sous l’influence de facteurs d’environnement.
Cette phrase est bien compliquée. Elle nous dit juste que cette maladie est liée à de la génétique, des facteurs d’environnement, il y a le microbiote et le système immunitaire qui s’activent dans l’intestin.
Dysbiose : un microbiote déséquilibré
Néanmoins, ces dernières années, on a des éléments qui suggèrent que certains facteurs environnementaux et certains facteurs génétiques vont en fait jouer sur le microbiote pour activer ces maladies, même si bien sûr tout ne passe pas forcément par le microbiote. Il y a d’autres facteurs qui vont influencer ces maladies et de manière complètement indépendante du microbiote.
On sait aujourd’hui que vraiment ce microbiote joue un rôle dans ces maladies et une des raisons est que ce microbiote est altéré chez les patients. C’est ce qui fait émerger le concept de dysbiose. Quand vous êtes en bonne santé et que vous avez un microbiote sain, vous avez dans votre intestin des bactéries anti-inflammatoires qui sont là en grande quantité dans l’intestin, mais qui envoient des signaux pacifiques à notre système immunitaire.
Ce qui fait qu’il n’y a pas d’inflammation dans notre intestin alors que pourtant il y a ces milliards et milliards de bactéries et en soi est déjà assez extraordinaire. En plus de ces bactéries anti-inflammatoires, vous avez quelques bactéries comme cette bactérie violette sur l’image qui va envoyer plutôt des signaux d’activation de l’immunité.
On peut la considérer comme pro-inflammatoire, mais en faible quantité. Ces bactéries sont aussi nécessaires parce qu’elle stimule notre immunité et elles permettent de garder notre système immunitaire prêt à réagir en cas de besoin. Donc là, on a un microbiote qui est équilibrée.
Dans les maladies inflammatoires de l’intestin, on voit ça, un déséquilibre du microbiote avec les bactéries pro-inflammatoires qui deviennent trop nombreuses et inversement les bactéries anti-inflammatoires dont l’abondance va diminuer, et ça joue un rôle dans la chronicité, la gravité et la sévérité de ces maladies.
Cibler le microbiote intestinal dans un but thérapeutique ?
Si on va à un échelon supplémentaire et qu’on se dit que le microbiote est impliqué : est-ce qu’on ne pourrait pas trouver un moyen pour améliorer la situation et de finalement trouver des médicaments et des traitements basés sur le microbiote pour améliorer la vie de ces patients?
L’objectif est de passer de cette situation à celle-là sur l’image d’en bas.
On peut utiliser des antibiotiques pour essayer de détruire ces mauvaises bactéries. Alors malheureusement, c’est une efficacité assez limitée parce que d’abord, les antibiotiques, c’est assez peu spécifique. On va dire qu’il y a des dommages collatéraux et ce n’est pas très bon. En plus sur le long terme, il y a des risques de résistance et de la toxicité, donc ce n’est pas une bonne idée et ça ne marche pas.
Seconde possibilité, les probiotiques classiques, c’est-à-dire les probiotiques que vous pouvez aujourd’hui trouver partout en pharmacie, sur Internet etc, qui sont des probiotiques issus essentiellement de produits fermentés ou de végétaux pour ces maladies inflammatoires de l’intestin. En tout cas, ça ne marche pas. Ce n’est pas forcément le cas dans le syndrome de l’intestin irritable. Dans le syndrome de l’intestin irritable, il y a certains probiotiques qui ont montré une efficacité chez certains patients, mais dans les MICI ça ne marche pas.
Probiotiques de nouvelle génération
Il y a un nouveau concept qui a émergé depuis quelques années, celui vers les probiotiques de nouvelle génération. L’idée, c’est d’aller trouver des bactéries qui sont présentes chez les sujets sains et qui diminuent ou s’absentent carrément chez les patients atteints de ces maladies pour les utiliser, les faire pousser dans une usine et les donner aux patients.
Donc là, on parle de probiotiques de nouvelle génération parce que ce ne sont plus des bactéries qu’on prend un petit peu au hasard dans l’environnement. Ce sont des bactéries qui viennent de l’intestin humain et que l’on a sélectionné pour leurs effets biologiques spécifiques.
Donc il y’a une de ces bactéries sur lesquels on a beaucoup travaillé, qui s’appelle Faecalibacterium Prausnitzii. Ce qui est intéressant, c’est que chez des sujets sains, cette bactérie est présente en très grande abondance. Elle représente à elle seule de l’ordre de 5% du microbiote humain et chez les patients qui ont une MICI, elle est fortement diminuée.
En plus de ça, elle a des effets anti-inflammatoires que notre équipe a démontrés et donc c’est vraiment un très bon candidat pour un probiotique de nouvelle génération dans ces maladies inflammatoires de l’intestin.
Il y a un essai clinique qui vient de commencer en Belgique, alors malheureusement pas en France encore, mais un essai clinique qui vient de commencer dans la maladie de Crohn en Belgique. On espère aussi que dans les prochaines années, on aura d’autres essais, y compris en France.
Transplantation de microbiote fécal (TMF)
Autre méthode beaucoup plus drastique encore pour modifier le microbiote, c’est la transplantation de microbiote fécal. L’idée, c’est de remplacer le microbiote anormal par le microbiote sain en espérant avoir des effets sur la santé.
Dans les MICI, on a des effets qui sont démontrés, on sait qu’il y a un certain effet. Alors ce n’est pas la révolution, ce n’est pas non plus des taux de succès absolument faramineux. Cependant, on pense de plus en plus qu’en combinant peut-être des approches qui visent le microbiote et puis des approches classiques qui cible le système immunitaire, on espère beaucoup plus de succès.
Néanmoins, le problème de la transplantation fécale, ce que c’est extrêmement complexe à mettre en œuvre. Si on ne maîtrise pas complètement ce que l’on fait, c’est difficile d’imaginer qu’on va utiliser ce genre de traitement pour traiter un très grand nombre de patients. 250 000 patients en France ont une maladie inflammatoire chronique de l’intestin.
Les patients qui ont un syndrome de l’intestin irritable, c’est encore plus. La transplantation fécale, c’est intéressant pour la recherche, mais pour des maladies chroniques et fréquente, on a beaucoup de mal à imaginer que l’on va utiliser cette technique sur le long terme.
Conclusion et récapitulatif
En conclusion, d’un point de vue thérapeutique, la transplantation fécale est intéressante, mais probablement peu applicable à très grande échelle pour des maladies fréquentes.
En revanche, grâce à ces études sur la transplantation fécale et à d’autres travaux, on peut identifier des bactéries qui sont intéressantes à utiliser comme probiotique de nouvelle génération, soit des mélanges de bactéries, soit des bactéries seules. Je vous ai parlé de Faecalibacterium Prausnitzii et on peut aussi imaginer d’utiliser des molécules qui sont produites par les bactéries : c’est le concept de post-biotique.
Comment protéger son microbiote ?
Donc les recommandations, c’est qu’il faut protéger son microbiote :
- Éviter de l’agresser avec une alimentation de mauvaise qualité.
- Eviter les antibiotiques quand ce n’est pas nécessaire. Évidemment, il ne s’agit pas de dire que les antibiotiques sont interdits, c’est juste qu’il faut les prendre quand c’est nécessaire.
- Éviter les aliments transformés et surtout ultra-transformés.
Il faut lui apporter de bonnes choses, des fruits, des légumes, des produits fermentés parce qu’on sait que tout ça est bon pour avoir un microbiote en bonne santé. On peut finalement considérer que notre microbiote, c’est un peu comme un animal de compagnie dont il faut prendre soin, sinon il n’est pas content.
Questions/réponses
Emmanuel de Fodmapedia : Concernant la nouvelle génération de probiotiques : sur quelle échelle de temps pourraient ils arriver en médecine courante, si cette piste aboutit ?
Pr. Harry Sokol : Il y a beaucoup d’études qui sont en cours. J’ai bon espoir que dans les cinq prochaines années, on commence réellement à voir des probiotiques de nouvelle génération arriver sur le marché.
La génération actuelle de probiotiques, si je comprends bien, c’est un peu la loterie. Ce sont des cocktails de souches. Certains en fonction des maladies ont des efficacités relatives, qui peuvent être intéressantes, mais chez certaines personnes, ça marche et d’autres, ça ne marche pas. Aujourd’hui, on ignore exactement à qui les attribuer. C’est bien cela ?
Oui, c’est ça. L’un des gros problèmes, c’est que l’écrasante majorité des probiotiques qui sont aujourd’hui en vente libre n’ont pas fait l’objet de grandes études, donc on ne sait même pas s’ils marchent en fait. Si on prend le cas du syndrome de l’intestin irritable qui est vraiment assez exemplaire dans ce cadre-là, il y a énormément de préparations disponibles. Cependant, l’écrasante majorité, on manque d’études cliniques ou alors des études avec des nombres de patients absolument ridicules qui ne permettent absolument pas de conclure.
Il y a quelques probiotiques qui ont fait des études plus importantes et qui montrent un effet effectivement chez certains patients. En tant que médecin, c’est souvent vers cela que l’on se dirige en premier parce qu’au moins, on a des données qui nous suggèrent que ça marche pour certains patients, mais après, il y a aussi une approche pragmatique, surtout sur le syndrome de l’intestin irritable où l’on peut conseiller aux patients intéressés d’essayer un probiotique. Si au bout de trois à quatre semaines, il ne se passe rien, d’arrêter, voire de tester un autre, mais c’est vrai que c’est un petit peu frustrant de faire comme cela.
Vous avez parlé aussi de transplantation de microbiote fécal. C’est une piste qui est vraiment intéressante et beaucoup de personnes creusent ça. On voit des analyses de microbiote, des kits d’analyse de selles en vente libre aujourd’hui. Qu’est-ce que l’on pense de ça ?
Ça, c’est un point absolument majeur. Je suis assez convaincu qu’avec le microbiote, on va pouvoir diagnostiquer certaines maladies peut-être, guider des traitements parce que comme le microbiote reflète notre état de santé pour beaucoup de choses. Il est assez logique de dire qu’il peut nous aider de la même manière qu’on fait des prises de sang. On pourrait tout à fait analyser le microbiote pour répondre à certaines questions médicales. Le problème, c’est qu’à ce jour, on manque d’éléments solides qui permettent réellement de tirer parti d’analyse de microbiote proposée actuellement.
Il n’y a pas aujourd’hui d’intérêt médical, ni pour les médecins ni pour les patients, a demander des analyses de microbiote. Ça ne va pas aider dans votre maladie où ça ne va pas aider votre médecin à choisir le bon médicament. D’ailleurs la société française de Gastro-entérologie a fait une communication officielle pour le dire parce qu’il y a aussi des patients qui font ces analyses de très bonnes volontés en espérant avoir un résultat. Cela peut leur coûter plusieurs centaines d’euros et quand ils entendent dire par leur médecin que ça ne sert pas à grand-chose et que ça ne les aide pas, c’est vrai que c’est un peu dommage.
C’est donc une piste extrêmement prometteuse mais on est aujourd’hui à l’état de recherche scientifique fondamentale et pour l’instant, on ne peut pas le recommander.
C’est ça, on est vraiment à la recherche. Il faut être honnête, il y a un petit peu de survente par ces sociétés de leurs produits parce qu’évidemment elles cherchent à vendre leur analyse mais non, à ce jour, malheureusement ça ne sert pas. Encore une fois, ça ne veut pas dire que je ne pense pas que ça ne va pas être utile. Je suis moi-même persuadé que l’on fera des analyses de microbiote dans les prochaines années pour aider au diagnostic, guider les traitements, etc.
Ça sera d’ailleurs probablement des analyses beaucoup plus ciblées que les analyses globale proposées aujourd’hui, qui sont une sorte de cartographie. Il est quand même beaucoup plus probable que dans la vie médicale réelle on fera une recherche très précise pour répondre à une question très précise. De la même manière que quand vous consultez votre médecin quand il fait une ordonnance pour une prise de sang, il n’écrit pas « pratiquer prise de sang ». Il demande des tests précis pour répondre à des questions précises. Il y a de fortes chances que ce soit pareil avec le microbiote.
L’objectif, c’est de pouvoir personnaliser la médecine avec des analyses de microbiote très probablement combinées avec des analyses sanguines aussi. C’est un peu le rêve actuellement, mais malheureusement à ce jour, on en est encore au niveau du rêve. Les recommandations, c’est ce que j’ai dit à la fin sur les recommandations vis-à-vis du microbiote, ce sont probablement des choses qui sont applicables à quasiment tout le monde en fait.
On est à quel stade de recherche sur la transplantation fécale pour le syndrome de l’intestin irritable ?
Alors là aussi, un mot sur la transplantation fécale dans le syndrome de l’intestin irritable. C’est exactement comme vous l’avez dit, il y a vraiment de tout dans les résultats, y compris des situations où la transplantation fécale va aggraver l’état du patient. Il ne faut pas non plus avoir comme idée que c’est forcément quelque chose qui ne peut être que bénéfique. Je coordonne le centre de transplantation fécale de l’AP-HP et donc on fait des transplantations fécales quasiment au quotidien pour une seule indication aujourd’hui, qui est une infection intestinale par une bactérie qui s’appelle Clostridium Difficile. Nous sommes sollicités par des patients qui ont un syndrome de l’intestin irritable et malheureusement on leur dit non, parce qu’il n’y a pas d’éléments suffisants aujourd’hui pour le faire.
Il y a une étude qui devrait commencer, j’espère fin 2023 à l’hôpital Avicenne, coordonnée par le professeur Sabaté mais pour l’instant, ce n’est pas encore le cas.
Ça nous est arrivé assez récemment, une patiente à qui on avait refusé de faire une transplantation fécale a été en faire une à l’étranger dans un pays de l’Est. Elle est revenue après cette transplantation dans un état bien pire qu’avant la transplantation fécale. Ce n’est pas un traitement anodin. La transplantation fécale, on peut transmettre des bactéries multirésistantes aux antibiotiques, on peut transmettre des infections et puis même sans ses problèmes spécifiques, on peut détériorer l’état digestif même si on n’est pas parfaitement bien avant la transplantation fécale, on peut être aussi beaucoup moins bien après.
Que pensez-vous des FODMAPS dans le cadre du syndrome de l’intestin irritable ?
C’est un outil qui est intéressant. Je ne suis pas un grand expert du syndrome de l’intestin irritable. Ce que je pense, c’est que les FODMAPS, c’est finalement tous les aliments de notre microbiote. Donc de faire un régime sans FODMAPS au début pour essayer d’identifier les facteurs qui sont délétères et qui provoquent les symptômes, je pense que c’est intéressant.
Maintenant, ce n’est clairement pas un régime qu’il va falloir prolonger de manière trop longue surtout si c’est un régime extrêmement strict parce que là, on risque d’être carencé et puis on va en fait altérer son microbiote encore plus.
Il faut qu’il y ait un contrôle si possible médical de ce régime. Un suivi peut-être avec des diététiciens ou n’importe quels autres outils comme par exemple l’outil que vous développez [Fodmapedia], et ne pas prolonger le régime trop strict, trop longtemps. Une fois que l’on a identifié les aliments qui sont les plus gênants, on peut les éliminer et après il faut réintroduire les autres.
Emmanuel de Fodmapedia : je vous rejoins, il est primordial de respecter la méthodologie qui est en trois phases. La phase stricte est censé durer seulement un mois et l’accompagnement par une diététicienne permet de réintroduire au plus vite les aliments en phase 2.
Est-ce qu‘il y a un lien entre le microbiote et les maladies comme l’autisme, la schizophrénie ?
D’un point de vue théorique, le microbiote peut avoir un effet sur le cerveau comme j’en ai parlé. Il y a de plus en plus de données le suggérant, y compris chez l’homme. Des anomalies du microbiote dans différentes maladies neuropsychiatriques, autisme, dépression, maladie de Parkinson ou autres. Maintenant, à ce jour, on manque d’éléments très solides pour dire là encore ce qu’il faut faire vis-à-vis du microbiote pour améliorer ces maladies.
Si on prend l’exemple de l’autisme. Ce que l’on voit souvent, c’est que ces patients ont des troubles digestifs associés, notamment une forte constipation. Ce que l’on peut conseiller, c’est de traiter la constipation. Il semble aussi qu’en traitant la constipation, ça améliore d’autres symptômes, y compris les symptômes neurologiques, donc les symptômes spécifiques de l’autisme.
Est-ce que c’est via le microbiote ou via d’autres phénomènes ? Ça on ne sait pas bien.
Il y a eu une étude qui a été fait à ce jour, en tout cas publiée, chez des personnes avec autisme et qui avait aussi d’ailleurs des troubles digestifs de type constipation qui ont eu une transplantation fécale avec une amélioration des troubles digestifs et aussi semble-t-il des troubles autistiques, sans guérison mais bien sûr avec une amélioration. C’est une petite étude sans groupe contrôle, donc c’est assez difficile de tirer des conclusions, mais c’est vrai que c’est encourageant sur le fait que jouer sur le microbiote pourrait avoir des effets. Il y a plusieurs autres études alors pour l’instant, pas en France à ma connaissance, pour évaluer l’effet de la transplantation fécale dans l’autisme.
On va parler de comorbidités, une question sur la corrélation entre l’endométriose et le microbiote intestinal. Après, c’est vrai que des maladies comme les MICI, Crohn, rectocolite ou syndrome d’intestin irritable, c’est assez fréquent ensemble. Parlez-nous un peu de ça.
À ma connaissance, il n’y a pas grand-chose pour l’endométriose spécifiquement et microbiote mais en revanche, il y a une association entre maladie de Crohn et endométriose. Comme la maladie de Crohn et microbiote où là il y a des grosses altérations, est-ce que via l’association avec la maladie de Crohn, il y a peut-être des altérations du microbiote ?
À ma connaissance, il n’y a pas de données particulières là-dessus.
Est-ce qu’il y a un examen pour détecter une dysbiose ou c’est à l’avenir ?
Je dirais que c’est surtout à l’avenir pour une raison simple. Admettons qu’aujourd’hui, il y a un test qui vous dit que vous avez une dysbiose si vous envoyez vos selles. Le problème, c’est que vous ne savez pas quoi faire avec ce résultat à vrai dire, c’est ça le problème majeur.
C’est-à-dire que c’est comme si je vous montre une photo du ciel étoilé et si comme moi vous n’y connaissez absolument rien en astronomie vous allez dire « c’est joli ». Je vois des choses, mais qu’est-ce que ça veut dire ? Je n’en sais rien en fait. C’est exactement pareil.
Le plus souvent, on va revenir aux recommandations que je vous ai données précédemment. Manger des fibres si c’est possible et en utilisant celles que l’on supporte. Limiter les agressions du microbiote et on revient un petit peu toujours à la même chose. Finalement en termes de recommandations, on se retrouve assez proche du régime méditerranéen qui est probablement un des meilleurs pour notre santé en général.
Est-ce qu’il y a un rôle de l’intestin dans les allergies, les intolérances alimentaires ?
Oui, bien sûr. Dans les allergies, le microbiote joue un rôle, ce fut démontré y compris chez l’homme. Notamment, les perturbations du microbiote tôt dans la vie dont je parlais dans la présentation pourrait jouer un rôle dans cette mauvaise éducation du système immunitaire et favoriser les allergies y compris hors de l’intestin.
Les allergies dans l’intestin ça je ne peux pas trop vous répondre. Est-ce qu’est-ce que le microbiote joue un rôle ? C’est possible, mais il y a moins d’éléments là-dessus.
Est-ce que votre métier de gastro-entérologue n’est pas en train d’évoluer fondamentalement ?
Vous êtes hépato-gastro-entérologue, donc c’est toute la sphère digestive et le foie. Maintenant il y a cette nouvelle prise en compte de l’axe intestin-cerveau pour les nouvelles générations de gastro. Est-ce que ce métier évolue et que maintenant, c’est vraiment pris en compte dans son ensemble ou ce n’est pas le cas encore ?
D’abord, il y a la connaissance du microbiote qui rentre vraiment dans la formation des médecins maintenant et c’est d’ailleurs assez étonnant si vous ouvrez des livres de biologie, de collèges et de lycées, vous avez des pans entiers sur le microbiote. C’est d’ailleurs assez impressionnant de voir la quantité d’informations qui est maintenant enseignée sur ce domaine.
En médecine, c’est aussi présent dans tout le domaine médical, même si c’est à mon sens pas encore assez. Les gastro-entérologues ont bien sûr une position particulière dans ce cadre-là, parce que c’est l’organe qui est le plus au contact du microbiote mais à mon sens, il faut que toutes les spécialités médicales se saisissent du domaine.
Les gastro-entérologues ne vont pas pouvoir s’occuper de tous les problèmes neurologiques, des problèmes pulmonaires, des allergies, ça ne va pas être possible. Le gastro-entérologue va garder une position un peu particulière vis-à-vis du microbiote, mais il faut que tous les collègues de toutes les spécialités se saisissent de ce domaine.
Les cancérologues ont bien commencé à s’y intéresser. Les dermatologues, les rhumatologues aussi ont commencé à s’y intéresser. Je pense qu’à l’avenir, c’est finalement que le microbiote imprègne toutes les couches de la médecine comme finalement, il a un impact sur toutes les couches de la médecine.
Un grand merci Pr. Sokol ! Cela fait plaisir de voir des gens passionnés et passionnants travailler sur nos thématiques.
Fodmapedia s’adresse aux personnes atteintes du syndrome de l’intestin irritable, qui doivent suivre un régime faible en fodmaps. C’est un moteur de recherche d’aliments : tapez n’importe quel aliment et vous saurez s’il est compatible ou non avec ce régime (quantité maximale, par quoi le remplacer s’il est interdit, explications…). Cette alimentation thérapeutique a prouvé son efficacité scientifique avec 75 % des personnes le suivant qui peuvent retrouver une vie normale.
👉 Les détails et mon avis de la BD du professeur Sokol « Les extraordinaires pouvoirs du ventre«